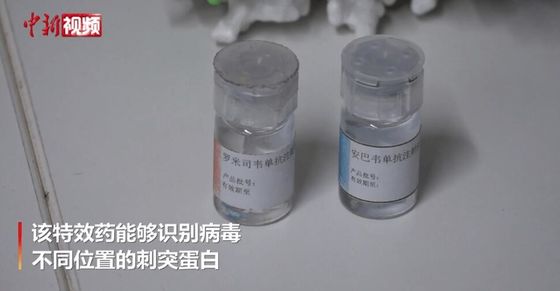
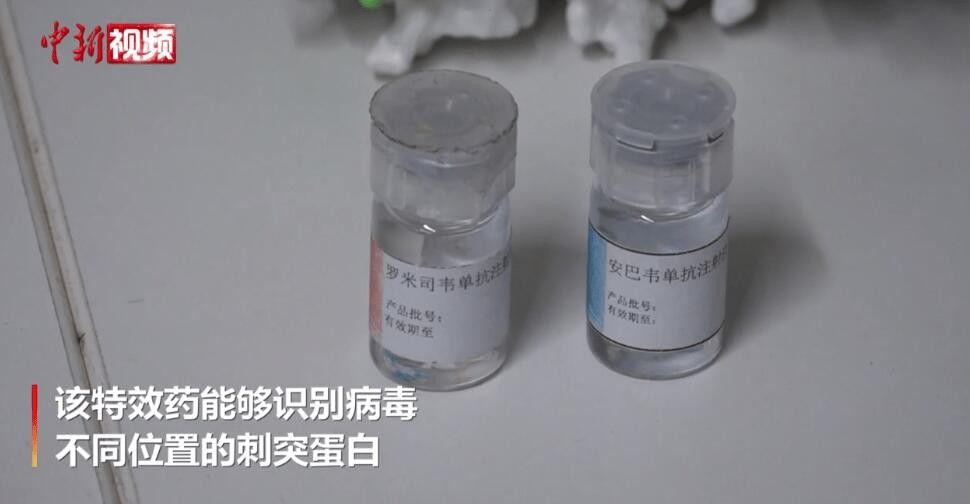
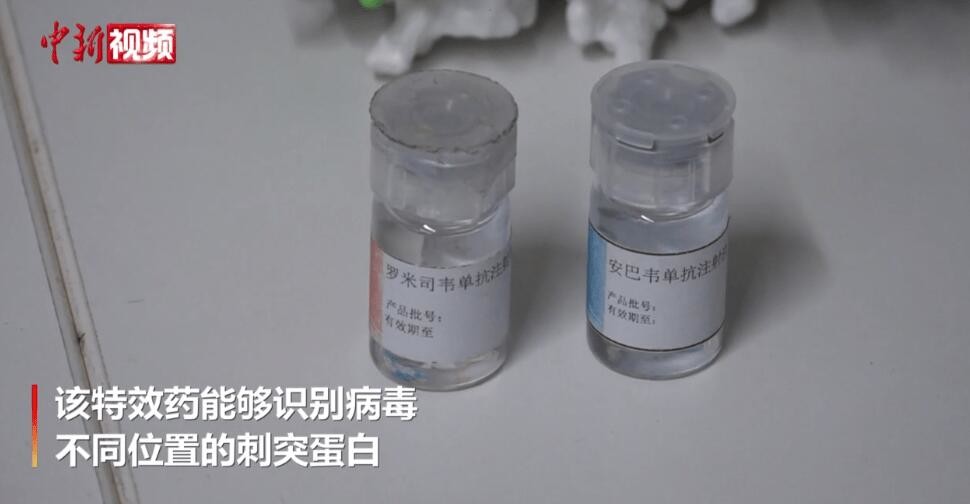
Descripción de producto
Descripción de los anticuerpos monoclonales de amubarvimab / romlusevimab (BRII-196/ BRII-198)
BRII-196 y BRII-198 no compiten con el SARS-CoV-2anticuerpos monoclonales neutralizantesderivados de pacientes con COVID-19 que se han recuperado.Los anticuerpos monoclonales han sido diseñados específicamente para reducir el riesgo de aumento dependiente de anticuerpos y prolongar las semividas plasmáticas para un efecto de tratamiento potencialmente más duradero.Además, sus regiones de unión de epítopos no superpuestas proporcionan un alto grado de actividad neutralizadora contra elEl SARS-CoV-2el betacoronavirus.
La combinación deSe aplicarán las disposiciones siguientes:¿Qué es?Además de la colaboración con el NIAID, Brii Biosciences está llevando a cabo estudios adicionales en China.que evalúa la farmacocinética y la seguridad de la combinación BRII-196/BRII-198 y un estudio de eficacia de fase 2 de la combinación BRII-196/BRII-198 para el tratamiento de la COVID-19.
La Compañía confirmó que se habían presentado solicitudes de Nuevo Medicamento de investigación para la terapia combinada a la Administración de Alimentos y Medicamentos de los Estados Unidos.
El...Administración Nacional de Productos Médicos de China(NMPA) otorgó la aprobación el 9 de diciembre de 2021 para la combinación amubarvimab/romlusevimab (anteriormente BRII-196/BRII-198 combinación),para el tratamiento en adultos y pacientes pediátricos(de 12 a 17 años de edad con un peso de al menos 40 kg) con el tipo leve y normal de COVID-19, con alto riesgo de progresión a enfermedad grave, incluida la hospitalización o la muerte.estudio de fase 3final results demonstrated a statistically significant 80% (78% in interim results) reduction of hospitalization and death with fewer deaths through 28 days in the treatment arm (0) relative to placebo (9), y un mejor resultado de seguridad en comparación con el placebo en pacientes no hospitalizados con COVID-19 con alto riesgo de progresión clínica a enfermedad grave.Se observaron tasas de eficacia similares en los participantes que iniciaron la terapia temprano (0 a 5 días) y tarde (6 a 10 días)., después del inicio de los síntomas, proporcionando evidencia clínica muy necesaria en pacientes con COVID-19 que llegaron tarde al tratamiento.
Brii Bio también(código de stock:2137- ¿ Qué?) es una empresa multinacional con sede en Durham, Carolina del Norte, Estados Unidos, y Beijing, China, que desarrolla terapias innovadoras para enfermedades con importantes necesidades médicas no satisfechas.Brii Biosciences Limited ha sido incluida como un stock constitutivo del¿ Qué pasa?Índice compuesto. Octubre 2021 corporativoPresentación. El 5 de diciembre de 2021, Brii Biosciences Limited fue añadida a la lista.Las acciones de Hong KongConectarse.
Historial de anticuerpos monoclonales del amubarvimab / romlusevimab (BRII-196/ BRII-198)
A principios de 2020, la Compañíaasociadoscon la Universidad de Tsinghua y el Hospital Tercer Pueblo de Shenzhen para establecer TSB Therapeutics para el desarrollo de BRII-196 y BRII-198.El amubarvimab y el romlusevimab son anticuerpos monoclonales neutralizantes del SARS-CoV-2 no competitivos derivados de pacientes convalecientes con COVID-19..
En menos de 20 meses,Brii Bio ha progresadola combinación amubarvimab/romlusevimab desde el descubrimiento hasta la finalización de la fase 3 del desarrollo que condujo a esta rápida aprobación por la NMPA.Esta aprobación representa la asociación muy exitosa con los mejores científicos e investigadores clínicos en China y en todo el mundo en una misión compartida, incluyendo el 3er Hospital Popular de Shenzhen y la Universidad de Tsinghua, que descubrieron estos anticuerpos neutralizantes; el Instituto Nacional de Salud de EE.UU., el Grupo de Pruebas Clínicas del SIDA,que patrocinó y dirigió el ensayo ACTIV-2.
Amubarvimab / Romlusevimab (BRII-196/ BRII-198) Indicación de anticuerpos monoclonales
El anticuerpo monoclonal BRII-196/ BRII-198 esindicadopara tratar a los pacientes no hospitalizados con COVID-19 con un alto riesgo de progresión clínica.pacientes pediátricos(de 12 a 17 años y con un peso mínimo de 40 kg) está bajo aprobación condicional en China.

 ¡Su mensaje debe tener entre 20 y 3.000 caracteres!
¡Su mensaje debe tener entre 20 y 3.000 caracteres! ¡Por favor revise su correo electrónico!
¡Por favor revise su correo electrónico!  ¡Su mensaje debe tener entre 20 y 3.000 caracteres!
¡Su mensaje debe tener entre 20 y 3.000 caracteres! ¡Por favor revise su correo electrónico!
¡Por favor revise su correo electrónico!